Mit dem idealen Gas befassen wir uns in diesem Artikel. Dabei wird erklärt, was man unter dem idealen Gas versteht, wie man damit rechnet und welche Unterschiede es zum realen Gas gibt. Dieser Artikel gehört zu unserer Rubrik Thermodynamik.
Im Bereich der Wärmlehre bzw. Thermodynamik ist es oftmals sehr wichtig, das Verhalten von Gasen richtig berechnen zu können. Bei den realen Gasen - so wie diese in der Natur vorliegen - haben die Atome bzw. Moleküle ein Volumen und zwischen den Teilchen treten Wechselwirkungen auf. Diese Eigenschaften des realen Gases mathematisch zu berechnen ist äußerst kompliziert. Aus diesem Grund wurde eine "abgespeckte" Version eingeführt, welches als ideales Gas bezeichnet wird und deutlich einfacher zu berechnen ist.
Unterschied: Reales Gas zu ideales Gas
Um Gase einfacher berechnen zu können, wurden bei dem idealen Gas folgende Vereinfachungen angenommen:
- Alle Gasteilchen werden als Massepunkte angenommen, die keinerlei Ausdehnung aufweisen
- Die mittleren Abstände der Gasteilchen voneinander sind sehr viel größer als die Durchmesser der Teilchen
- Alle Gastteile haben untereinander bzw. mit den Wänden des Volumens nur ideal elastische Stoßvorgänge
Diese Vereinfachungen entsprechen natürlich nicht der Realität. Ließe man keine Stöße zu, so könnte man das Gas nicht in einem Volumen festhalten, da es die Wand nicht bemerken würde. Außerdem behielte jedes Gasteilchen für alle Zeiten seine Anfangsgeschwindigkeit. Trotz dieser Näherung für die Gase, lassen sich mit dem idealen Gas in den meisten Fällen ausreichend genaue Daten für thermodynamische Zusammenhänge berechnen.
Ideales Gas: Zustandsgleichungen
Die Zustandsgleichungen werden zur Beschreibung idealer Gase verwendet und werden oftmals als allgemeine Gasgleichung bezeichnet. Diese liefern einen Zusammenhang zwischen den Größen Druck, Volumen, Stoffmenge und der absoluten Temperatur. Da die Stoffmenge in Mol angegeben wird, gleich noch ein Lesetipp: Mol / Molare Masse. Folgende Formeln werden dabei regelmäßig in der Literatur angegeben:
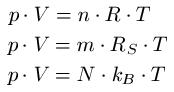
Dabei ist:
- "p" ist der Druck in Pascal oder Newton pro Quadratmeter [Pa oder N / m2 ]
- "V" ist das Volumen in Kubikmeter [ m3 ]
- "n" ist die Stoffmenge in Mol [ mol ]
- "R" ist die universelle Gaskonstante in Joule pro Kelvin mal Mol [ J / Kmol ]
- "T" ist die Temperatur in Kelvin [ K ]
- "m" ist die Masse des Gases in Kilogramm [ kg ]
- "RS" ist die spezifische Gaskonstante in Joule pro Kelvin mal Kilogramm [ J / (kg · K) ]
- "N" entspricht der Anzahl der Teilchen, Einheitenlos
- "kB" oder "k" ist die Boltzmann-Konstante in Joule pro Kelvin [ J / K ]
Konstante Werte:
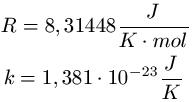
Beispiel:
In einem Gefäß mit einem Volumen von 0,05m3 herrscht ein Druck von 12 MegaPascal. Es herrscht eine Temperatur von 20 Grad Celsius und das Gefäß ist mit Sauerstoff gefüllt. Wie groß ist die Masse des Sauerstoffs?
Lösung: Um Von Celsius auf Kelvin zu kommen, addiert man auf auf den Celsiuswert die Zahl 273 drauf (gerundeter Wert) und erhält T = 293K ( Rechnung: 20 + 273 = 293 ). Die spezifische Gaskonstante von Sauerstoff entnehmen wir einer Tabelle und erhalten RS = 259,8 J · kg-1 · K-1. Zu dem steht im Text V = 0,05m3 und p = 12 · 106 N/m2.
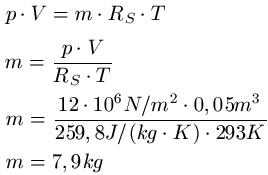
Links:
258 Gäste online
Anzeige:
Anzeige:
Verfügbare Fächer:
Anzeige:
Anzeige:
