In diesem Artikel erklären wir das Orbitalmodell der Chemie. Dabei handelt es sich um ein Modell, welches auf den Erkenntnissen von Rutherford und Bohr basiert und zudem einige Erkenntnisse der Quantenmechanik berücksichtigt. Dies ist ein Artikel zu den Grundlagen der Chemie.
Zunächst zwei kleine Hinweise: Dieser Artikel ist Teil unserer Serie Atommodelle der Chemie, in welcher wir verschiedene Atommodelle beschreiben und erklären. Dieser Artikel befasst sich mit dem Orbitalmodell, welches auf den Erkenntnissen von Rutherford und Bohr aufbaut. Deshalb ist es sinnvoll, dass ihr schon einmal von diesen beiden Atommodellen gehört hab. Alle, bei denen dies nicht der Fall ist, sollten die beiden folgenden Links aufrufen und sich die jeweiligen Artikel erst einmal durchlesen.
Das Orbitalmodell
Zu Beginn des 20. Jahrhunderts haben kluge Köpfe wie Albert Einstein, Werner Heisenberg und Erwin Schrödinger wichtige Erkenntnisse im Bereich der Quantenmechanik - einem Teilgebiet der Physik - errungen. Durch ihre Erkenntnisse konnten unter anderem die bisherigen Atommodelle verbessert werden. Im nun Folgenden soll dabei auf die Grundgedanken des Orbitalmodells eingegangen werden. Auf die komplexen mathematischen Hintergründe soll hier hingegen nicht eingegangen werden. Stattdessen soll eine Grundvorstellung des Modells vermittelt werden, wobei wir auch auf die etwas vereinfachte Version des Kugelwolkenmodells zurückgreifen.
Aufenthaltsbereich als Kugeln:
Im Orbitalmodell stellt man sich den Aufenthaltsbereich aller Elektronen als Kugeln vor. Und auch wenn es seltsam klingt: Man weiß nicht genau, wo sich die Elektronen in dieser Kugel befinden. Dieses Phänomen wird als Heisenbergsche Unschärferelation bezeichnet und wurde vom Nobelpreisträger Werner Karl Heisenberg aufgestellt. Es besagt, dass bestimmte Messgrößen eines Teilchens nicht gleichzeitig beliebig genau bestimmt werden können.
Man kann sich das allerdings auch etwas einfacher erklären: Stellt euch eine nervende Mücke vor, die sich nachts um eure Lampe bewegt. Das Licht der Lampe zieht die Mücke in ihren Bann und lässt sie näher kommen. Durch die Hitze der Lampe hingegen, wird die Mücke jedoch etwas auf Abstand gehalten. Der kleine Plagegeist fliegt also in einigen Zentimeter Abstand um die Lampe umher. Wo genau, wisst ihr nicht. Nur halt, dass sie in der Nähe der Lampe ist. So ist es auch mit dem Elektron: Man weißt recht gut in welchem Bereich es sein muss, jedoch die wirklich genaue Position ist nicht zu erkennen.
Kugelzahl und Spin
Die Anzahl der Kugeln ist von der Größe der jeweiligen Schale abhängig. Auf der ersten Schale ist Platz für eine Kugel, auf der zweiten für vier Kugeln. Nach außen hin steigt somit der Platz. Jede einzelne Kugel hat Platz für maximal zwei Elektronen. Jedes Elektron hat einen "Drall", auch Spin genannt. Innerhalb einer Kugelwolke besitzen die beiden Elektronen entgegengesetzten Spin, sie bewegen sich also in entgegengesetzter Richtung. Dies ist auch der Grund, warum nur zwei Elektronen pro Kugel Platz haben.
Dies soll nun anhand von einigen Beispielen noch einleuchtender werden. Dabei betrachten wir zunächst das erste Element des Periodensystems der Elemente (Periodensystem in neuem Fenster anzeigen). Es handelt sich dabei um Wasserstoff (H). Das Wasserstoff hat ein Proton im Kern und ein Elektron in der Hülle. Beim Helium (He) sind es zwei Protonen im Kern und zwei in der Hülle. Soweit eigentlich nichts ungewöhnliches.
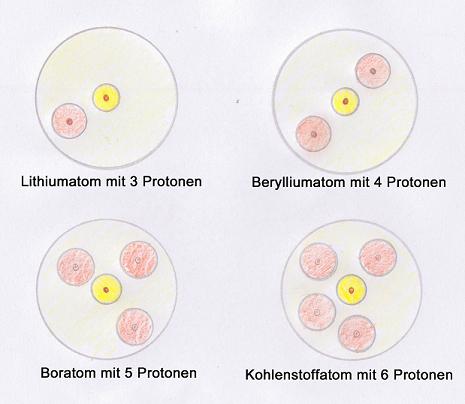
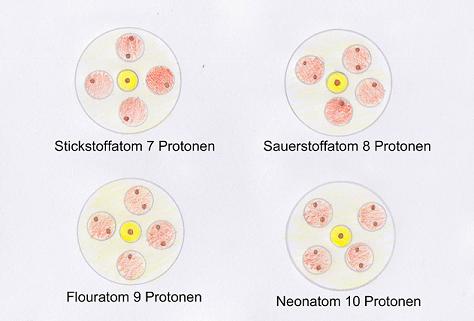
Interessant wird es nun, wenn die innerste Schale vollständig gefüllt ist, was bei 2 Elektronen (also beim Helium bereits) der Fall ist. Ab dann wird die zweite Schale besetzt. Die folgenden Grafiken verdeutlichen dies besser als Text. Soviel sei jedoch gesagt: Die nachfolgenden 8 Elemente (Lithium bis Neon) besitzen Elektronen in der zweiten Schale. Dabei werden die Kugeln nach und nach erst mit einem Elektron gefüllt und sobald alle 4 Kugeln je 1 Elektron haben, wird ein zweites Elektron eingebracht. In der dritten Schale beginnt dieser Prozess mit aufsteigender Elektronenzahl von vorne.
Hinweis: Die Anzahl der Elektronen und Protonen sind bei den Elementen gleich.
Die Quantenzahlen
Ein Elektron kann aufgrund von so genannten Quantenzahlen beschrieben werden. Mit Quantenzahlen lässt sich ein Zustand beschreiben. Für das Orbitalmodell werden vier Quantenzahlen ausgegeben, die wir im nun Folgenden betrachten möchten. Dabei unterscheiden wird zwischen der Hauptquantenzahl n, der Nebenquantenzahl l, der Magnetquantenzahl m und dem Spin s. Dabei gilt:
- Die Hauptquantenzahl "n" (wobei n eine natürlich Zahl ist: 1, 2, 3...) gibt an, auf welcher Schale sich ein Elektron wahrscheinlich befindet. Dabei gilt die Heisenbergsche Unschärferelation, welche wir weiter oben im Artikel bereits erklärt haben (Tipp: Nochmal nachlesen). Je größer die Zahl "n" ist, desto weiter ist das Elektron vom Atomkern entfernt.
- Die Nebenquantenzahl "l" (wobei l eine ganze Zahl von 0, 1, 2, ... bis n-1) kennzeichnet die Form eines Orbitals und ist auch ein Maß für den Drehimpuls des Elektrons.
- Die Magnetquantenzahl "m" (wobei m eine ganze Zahl zwischen -l bis +l ist) beschreibt die räumliche Ausrichtung, die das Orbital bezüglich eines äußeren Magnetfeldes einnimmt. Die resultierenden Orbitale sind energetisch gleich, nur wenn von außen ein Magnetfeld angelegt wird, ist eine Unterscheidung möglich.
- Über die Spinquantenzahl (die entweder s = + 0,5 oder s = -0,5 ist) wurde bereits oben gesprochen. Zur Erinnerung: Es können pro Orbital maximal zwei Elektronen Platz finden, die entgegengesetzten Spin aufweisen müssen.
Links:
321 Gäste online
Anzeige:
Anzeige:
Verfügbare Fächer:
Anzeige:
Anzeige:
