Mit dem Zusammenhang zwischen Druck und Temperatur befassen wir uns in diesem Artikel. Dazu werden auch entsprechende Beispiele vorgestellt. Dieser Artikel gehört zum Bereich Thermodynamik.
Die Gasgesetze werden zur Beschreibung idealer Gase eingesetzt. Dabei liefern die Formeln zu den Gasgesetzen einen Zusammenhang zwischen den Größen Druck, Volumen, Stoffmenge und der absoluten Temperatur. Die Stoffmenge wird in Mol angegeben. Hier noch kurz einige Links zu Artikeln mit sinnvollen Vorkenntnissen:
Druck und Temperatur Abhängigkeit
Zum Gasgesetz: Unter der Bedingung einer abgeschlossenen Gasmenge besteht für das ideale Gas der folgende Zusammenhang:
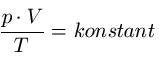
Beispiel:
Eine Gasmenge hat bei einer Temperatur von 0°C einen Druck von 105 Pa und ein Volumen von 1m3. Welcher Druck wird sich einstellen, wenn die Gasmenge auf ein Volumen von 2m3 und eine Temperatur von 100°C gebracht wird?
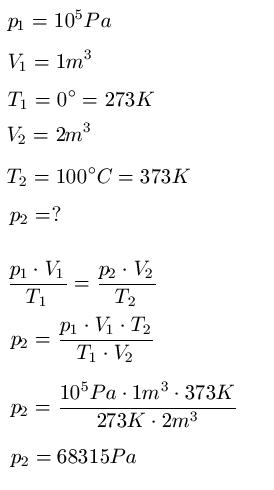
Weitere Formeln
Zur Berechnung der Zusammenhänge zwischen Temperatur und Druck existieren eine Reihe weiterer Formeln, die wir euch nun vorstellen möchten. Unterhalb der Formeln findet ihr Informationen, wofür die jeweiligen Variablen stehen und ein Anwendungsbeispiel.
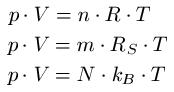
Dabei ist:
- "p" ist der Druck in Pascal oder Newton pro Quadratmeter [Pa oder N / m2 ]
- "V" ist das Volumen in Kubikmeter [ m3 ]
- "n" ist die Stoffmenge in Mol [ mol ]
- "R" ist die universelle Gaskonstante in Joule pro Kelvin mal Mol [ J / Kmol ]
- "T" ist die Temperatur in Kelvin [ K ]
- "m" ist die Masse des Gases in Kilogramm [ kg ]
- "RS" ist die spezifische Gaskonstante in Joule pro Kelvin mal Kilogramm [ J / (kg · K) ]
- "N" entspricht der Anzahl der Teilchen, Einheitenlos
- "kB" oder auch "k" ist die Boltzmann-Konstante in Joule pro Kelvin [ J / K ]
Konstante Werte:
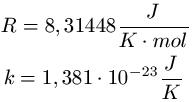
Beispiel:
Zum besseren Verständnis ein Beispiel zu den Gasgesetzen und damit auch zum Zusammenhang zwischen Druck und Temperatur: In einem Gefäß mit einem Volumen von 0,05m3 herrscht ein Druck von 12 MegaPascal. Es herrscht eine Temperatur von 20 Grad Celsius und das Gefäß ist mit Sauerstoff gefüllt. Wie groß ist die Masse des Sauerstoffs?
Lösung: Um Von Celsius auf Kelvin zu kommen, addiert man auf auf den Celsiuswert die Zahl 273 drauf und erhält T = 293K ( 20 + 273 = 293 ). Die spezifische Gaskonstante von Sauerstoff entnehmen wir einer Tabelle und erhalten RS = 259,8 J · kg-1 · K-1. Zu dem steht im Text V = 0,05m3 und p = 12 · 106 N/m2.
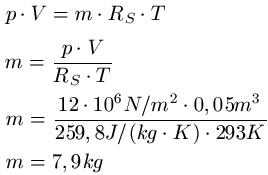
Links:
185 Gäste online
Anzeige:
Anzeige:
Verfügbare Fächer:
Anzeige:
Anzeige:
