Mit der spezifischen Wärmekapazität von Stoffen befassen wir uns in diesem Artikel. Dabei befassen wir uns auch mit verschiedenen Übertragungsverfahren von Wärme und nennen auch passende Beispiele und Formeln. Dieser Artikel gehört zum Bereich Thermodynamik.
Die spezifische Wärmekapazität - welche in Formeln als "c" bezeichnet wird - ist eine Stoffkonstante. Sie gibt an, wie viel Wärme von einem Körper aufgenommen oder abgegeben werden muss, damit sich die Temperatur von 1kg des Stoffes um 1 Grad Celsius ändert. Die spezifische Wärmekapazität ist von Stoff zu Stoff unterschiedlich, bei Wasser beträgt sie c = 4190J · kg-1K-1.
Spezifische Wärmekapazität zur Wärmeübertragung
Die spezifische Wärmekapazität findet Einzug in die Formel zur Grundgleichung der Wärmelehre. Damit kann die Wärme berechnet werden, die ein Körper aufnimmt oder abgibt. Die Formel darf nur eingesetzt werden, wenn sich der Aggregatzustand des Körpers nicht verändert ( Lesetipp: Aggregatzustand ). Die Formel zur Berechnung lautet dann:
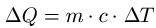
Dabei ist:
- "ΔQ" ist Änderung der Wärmeenergie in Joule [ J ]
- "m" ist die Masse in Kilogramm [ kg ]
- "c" ist die spezifische Wärmekapazität in Joule pro Kilogramm mal Kelvin [ J / ( kg · K ) ]
- "ΔT" ist die Temperaturänderung in Kelvin [ K ]
Beispiel:
Zwei Liter Wasser sollen von 20 Grad auf 80 Grad erwärmt werden. Welche Wärme ist dafür nötig?
Lösung: Die Menge Wasser kann direkt als Gewicht angegeben werden, da 2 Liter Wasser einer Masse von 2kg entsprechen, damit ist m = 2kg. Die spezifische Wärmekapazität von Wasser entnimmt man einer Tabelle und beträgt c = 4190J · kg-1K-1. Die Temperaturdifferenz beträgt 60 Grad Celsius, was auch 60 Kelvin entspricht.
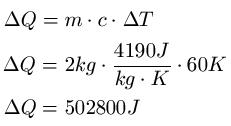
Spezifische Wärmekapazität für Mischtemperaturen
Die spezifische Wärmekapazität wird auch für die Mischtemperatur von zwei Stoffen / Körpern benötigt. Es gilt: Haben zwei Körper unterschiedlicher Temperatur Kontakt, so gibt der Körper mit höherer Temperatur Wärme an den Körper mit niedriger Temperatur ab. Der kältere Körper wird dadurch wärmer, der wärmere wird kälter. Dieser Vorgang läuft solange ab, bis beide Körper die gleiche Temperatur erreichen. Die abgegebene Wärme ist gleich der aufgenommenen Wärme. Die Mischtemperatur lässt sich wie folgt berechnen:
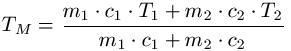
Dabei ist:
- "TM" ist die Mischtemperatur in Celsius [ C ]
- "c1" ist die spezifische Wärmekapazität des ersten Stoffes in Joule pro Kilogramm mal Celsius [ J / ( kg · C ) ]
- "c2" ist die spezifische Wärmekapazität des zweiten Stoffes in Joule pro Kilogramm mal Celsius [ J / ( kg · C ) ]
- "m1" ist die Masse des ersten Stoffes in Kilogramm [ kg ]
- "m2" ist die Masse des zweiten Stoffes in Kilogramm [ kg ]
- "T1" ist die Temperatur des ersten Stoffes in Celsius [ C ]
- "T2" ist die Temperatur des zweiten Stoffes in Celsius [ C ]
Sofern c1 = c2 ist ( sprich zwei gleiche Stoffe vermischt werden und damit die gleiche spezifische Wärmekapazität aufweisen ) vereinfacht sich die Formel zu:
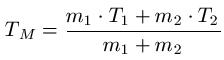
Beispiel:
Wir mischen 12 Liter Wasser mit einer Temperatur von 20 Grad Celsius mit 18 Litern Wasser mit einer Temperatur von 40 Grad Celsius. Welche Endtemperatur stellt sich ein?
Lösung: Dem Text entnehmen wir m1 = 12kg, T1 = 20C, m2 =18kg und T2=40C und setzen dies in die Formeln ein.
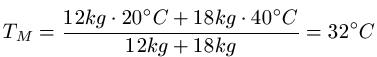
Links:
226 Gäste online
Anzeige:
Anzeige:
Verfügbare Fächer:
Anzeige:
Anzeige:
