Mit den Zustandsgleichungen befassen wir uns in diesem Artikel. Dabei beschränken wir uns auf die Berechnung idealer Gase und liefern dazu ein entsprechendes Beispiel. Dieser Artikel gehört zum Bereich Thermodynamik.
Die Zustandsgleichungen werden zur Beschreibung idealer Gase ( Lesetipp: Ideales Gas ) verwendet und oftmals als allgemeine Gasgleichung bezeichnet. Die Formeln der Zustandsgleichungen liefern einen Zusammenhang zwischen den Größen Druck, Volumen, Stoffmenge und der absoluten Temperatur. Da die Stoffmenge in Mol angegeben wird, gleich noch ein weiterer Lesetipp: Mol / Molare Masse.
Zustandsgleichungen Formeln:
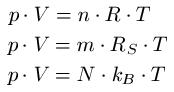
Dabei ist:
- "p" ist der Druck in Pascal oder Newton pro Quadratmeter [Pa oder N / m2 ]
- "V" ist das Volumen in Kubikmeter [ m3 ]
- "n" ist die Stoffmenge in Mol [ mol ]
- "R" ist die universelle Gaskonstante in Joule pro Kelvin mal Mol [ J / Kmol ]
- "T" ist die Temperatur in Kelvin [ K ]
- "m" ist die Masse des Gases in Kilogramm [ kg ]
- "RS" ist die spezifische Gaskonstante in Joule pro Kelvin mal Kilogramm [ J / (kg · K) ]
- "N" entspricht der Anzahl der Teilchen, Einheitenlos
- "kB" oder "k" ist die Boltzmann-Konstante in Joule pro Kelvin [ J / K ]
Konstante Werte:
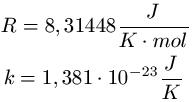
Beispiel:
Zum besseren Verständnis ein Beispiel zu den Zustandsgleichungen: In einem Gefäß mit einem Volumen von 0,05m3 herrscht ein Druck von 12 MegaPascal. Es herrscht eine Temperatur von 20 Grad Celsius und das Gefäß ist mit Sauerstoff gefüllt. Wie groß ist die Masse des Sauerstoffs?
Lösung: Um von Celsius auf Kelvin zu kommen, addiert man auf auf den Celsiuswert die Zahl 273 drauf und erhält T = 293K ( 20 + 273 = 293 ). Die spezifische Gaskonstante von Sauerstoff entnehmen wir einer Tabelle und erhalten RS = 259,8 J · kg-1 · K-1. Zu dem steht im Text V = 0,05m3 und p = 12 · 106 N/m2. Dies setzen wir in die Gleichung ein:
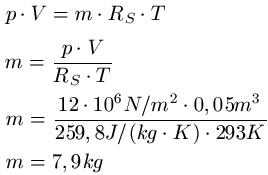
Links:
403 Gäste online
Anzeige:
Anzeige:
Verfügbare Fächer:
Anzeige:
Anzeige:
